Czy można wydłużyć okres trwałości leku w fiolce?
Autorzy: Dr Alan-Shaun Wilkinson1,2; mgr inż. Vibeke V. Casperson2; dr Michael C. Allwood2 i mgr inż. Marc Sutton3 1Uniwersytet Derby, 2Laboratorium Biopharma Stability Testing Laboratory Limited (BSTL); 3Dział zapewnienia jakości apteki szpitalnej w Królewskim Szpitalu hrabstwa Derbyshire, Derby, Zj. Król. Rysunek 1. Adaptor fiolki Tevadaptor® zestawiony ze szklaną fiolką.
Czy można wydłużyć okres trwałości leku w fiolce?
Celem badania była weryfikacja hipotezy zakładającej, że system zamknięty Tevadaptor® można zastosować do wydłużania praktycznego okresu trwałości leków przez zachowanie integralności mikrobiologicznej i fizykochemicznej podczas wykonywania wielokrotnych pobrań z jednorazowych fiolek niekonserwowanych leków.
Przygotowanie potencjalnie cytotoksycznych preparatów do wstrzykiwania uznaje się za procedurę niebezpieczną ze względu na możliwe uwolnienie do otoczenia cząsteczek leku i oparów lub kropli podczas zestawiania(1,2). Co za tym idzie kluczowe znaczenie ma zapewnienie bezpieczeństwa operatora wykonującego to zadanie(3). Ta potrzeba doprowadziła do opracowania urządzeń do transferu w systemie zamkniętym (CSTD) mających na celu zapewnienie ochrony operatora wykonującego niebezpieczne transfery leków przy jednoczesnym zminimalizowaniu ryzyka zanieczyszczenia mikrobiologicznego(4). Daje się zaobserwować wzrastającą presję wywieraną na farmaceutów szpitalnych, aby zmniejszali oni koszty ponoszone na zakup leków ze względu na rosnące wydatki na opiekę zdrowotną w szpitalach, zwłaszcza w dziedzinie onkologii. Koszty leków, szczególnie w przypadku leków biologicznych, stanowią znaczną część całkowitych wydatków na opiekę zdrowotną(5). Jednym z rozwiązań tego problemu jest optymalizacja fiolki leku (DVO) przez stosowanie urządzenia do transferu w systemie zamkniętym (CSTD), które może spełniać rolę pojemnika do przechowywania, pomagając wydłużać praktyczny okres trwałości fiolki leku po pierwszym nakłuciu(6). Wiadomo, że prowadzone były badania mające na celu ocenę zdolności jednego powszechnie dostępnego urządzenia CSTD, przeznaczonego do utrzymywania sterylności mikrobiologicznej w czasie do 7 dni we fiolce niekonserwowanego leku(4,7). W badaniach tych nie zostały jednak przytoczone dane dotyczące integralności chemicznej aktywnego składnika farmaceutycznego (API), co stanowi argument wstępny za wydłużeniem okresu trwałości. Badanie to dostarcza danych(15) dotyczących stosowania adaptera Tevadaptor® (Rysunek 1) stanowiącego część systemu pojemnika fiolki leku, nadającego się do powtarzalnego pobierania niebezpiecznych leków, gwarantującego zachowywanie sterylności i integralności fizykochemicznej przez okres do 28 dni po pierwszym nakłuciu zgodnie z rozdziałem <797> Farmakopei Stanów Zjednoczonych (USP) dotyczącym datowania poza użyciem (BUD)(8).
Utrzymywanie sterylnej bariery
Zdolność systemu Tevadaptor® do utrzymywania sterylnej bariery poddano ocenie przez zestawienie adaptorów fiolek Tevadaptor® ze szklanymi fiolkami o pojemności 100 ml typu 1 zawierającymi 50 ml sterylnego podłoża hodowlanego TSB (n=332). Z każdej fiolki pobrano podwielokrotne części (5 ml) w dniach 0, 7, 14 i 28 (n=332), zestawiając adaptor strzykawki Tevadaptor® z adaptorem fiolki, po czym pobierając podłoże hodowlane przy użyciu sterylnej strzykawki o pojemności 5 ml. Wszystkie czynności wykonano w środowisku klasy V wg norm ISO. Każdą strzykawkę zabezpieczono i poddano inkubacji przez 14 dni w temperaturze 35 ± 1°C, po czym poddano kontroli pod kątem obecności oznak rozwoju mikroorganizmów. Po pobraniu ostatniej próbki w 28 dniu fiolkę zawierającą pozostałą część podłoża hodowlanego (10 ml) poddano inkubacji przez 14 dni w temperaturze 35 ± 1°C, po czym poddano kontroli pod kątem występowania rozwoju mikroorganizmów. W żadnej z próbek pobranych w 28-dniowym okresie testowym, ani też w podłożu hodowlanym pozostałym we fiolce, nie stwierdzono żadnych oznak rozwoju mikroorganizmów (Tabela 1). Zdolność promocji wzrostu podłoża użytego w tym badaniu została zweryfikowana w drodze badań promocji wzrostu (GPT) na panelu mikroorganizmów wymienionych w zbiorze ATCC (kontrole pozytywne).

<>Stabilność fizykochemiczna podczas stosowania w przypadku trzech leków cytotoksycznych
Ocenie poddano stabilność fizykochemiczną trzech reprezentatywnych leków przeciwnowotworowych, cisplatyny (roztwór 1 mg/ml, fiolka o pojemności 100 ml), metotreksatu (roztwór 25 mg/ml, fiolka o pojemności 40 ml) i paklitakselu (roztwór 6 mg/ml, fiolka o pojemności 50 ml). W tym celu w 28-dniowym okresie użytkowania zastosowano adapter fiolki Tevadaptor® zestawiony z fiolkami testowymi. Badania obejmowały pomiar współczynnika pH roztworu, ocenę metodą wysokosprawnej chromatografii cieczowej z detekcją diodową i kontrolę wzrokową obecności cząstek stałych i klarowności. Wyniki dla próbek testowych, pobranych z fiolek zestawionych z adapterem fiolki Tevadaptor®, porównano z próbkami pobranymi z próbek kontrolnych, w przypadku których lek został pobrany przy użyciu jednorazowej strzykawki i igły (bez zastosowania urządzenia do transferu w systemie zamkniętym). Próbki pobrano zgodnie z instrukcją użytkowania adapterów Tevadator® i instrukcjami właściwych producentów leków. Do każdego pobrania próbek z fiolek zestawionych z adapterami fiolek Tevadaptor® użyto nowego adaptora strzykawki Tevadaptor® i jednorazowej strzykawki, a do każdego pobrania z fiolek kontrolnych użyto sterylnej strzykawki. Próbki pobrano 0, 7, 14, 21 i 28 dnia. Badania wykonano niezwłocznie po pobraniu.
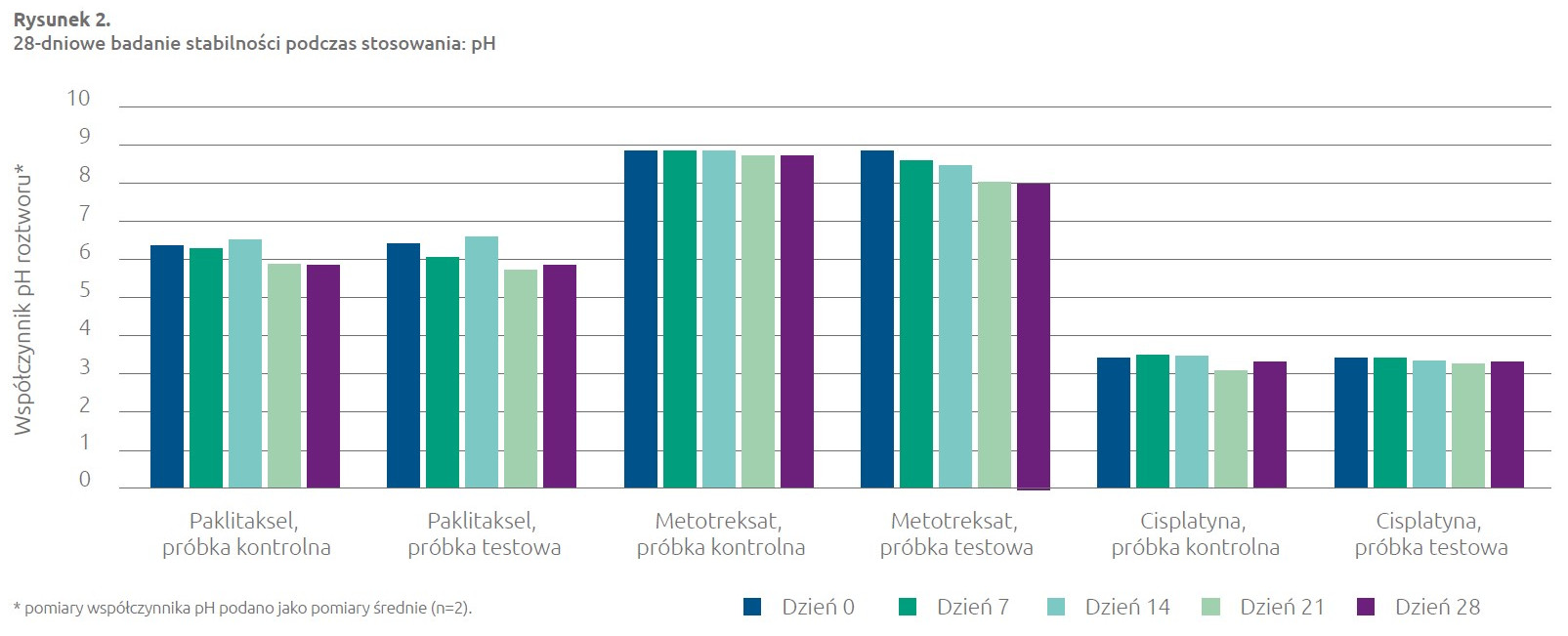
Współczynnik pH roztworu
Współczynnik pH roztworu zmierzono na próbkach testowych lub kontrolnych (n=2) przy użyciu skalibrowanego pH-metru wyposażonego w standardową szklaną elektrodę pH z jednym złączem. Narzędzie skalibrowano w dniu użycia, a także przed pomiarem próbek (przy użyciu roztworów spełniających standard NIST przy pH 4,0; pH 7,0 i pH 10,0). Przed użyciem przeprowadzono kontrole liniowości systemu pomiaru współczynnika pH. Ustalono kryteria przyjęcia dla wskazania stabilności leku, które dla wszystkich próbek roztworu przewidywały utrzymanie wartości w zakresie ± 0,5 jednostki pH odpowiedniego roztworu próbki kontrolnej. Podsumowanie wyników badań przedstawia poniższy Rysunek 2. W przypadku paklitakselu i cisplatyny wszystkie wyniki próbek testowych mieściły się w zakresie ± 0,5 jednostek pH w odniesieniu do próbek kontrolnych. W przypadku próbek metotreksatu próbki testowe z 0, 7 i 14 dnia również osiągnęły wartości mieszczące się w zakresie ± 0,5 jednostki pH próbek kontrolnych, jednak próbki z 21 i 28 dnia odbiegały wartościami o 0,7 jednostki pH. W obu zestawieniach próbek metotreksatu (próbki kontrolne i testowe) występuje nieznaczna tendencja spadkowa pod względem wartości pH w miarę upływu czasu. Mimo jednak tendencji spadkowej, wszystkie próbki osiągnęły wartości solidnie mieszczące się w zakresie 7,0–9,0 pH specyfikacji produktu określonej w monografiach poświęconych metotreksatowi do wstrzyknięć (13, 14), ujętych w Farmakopei Stanów Zjednoczonych i Farmakopei Brytyjskiej.
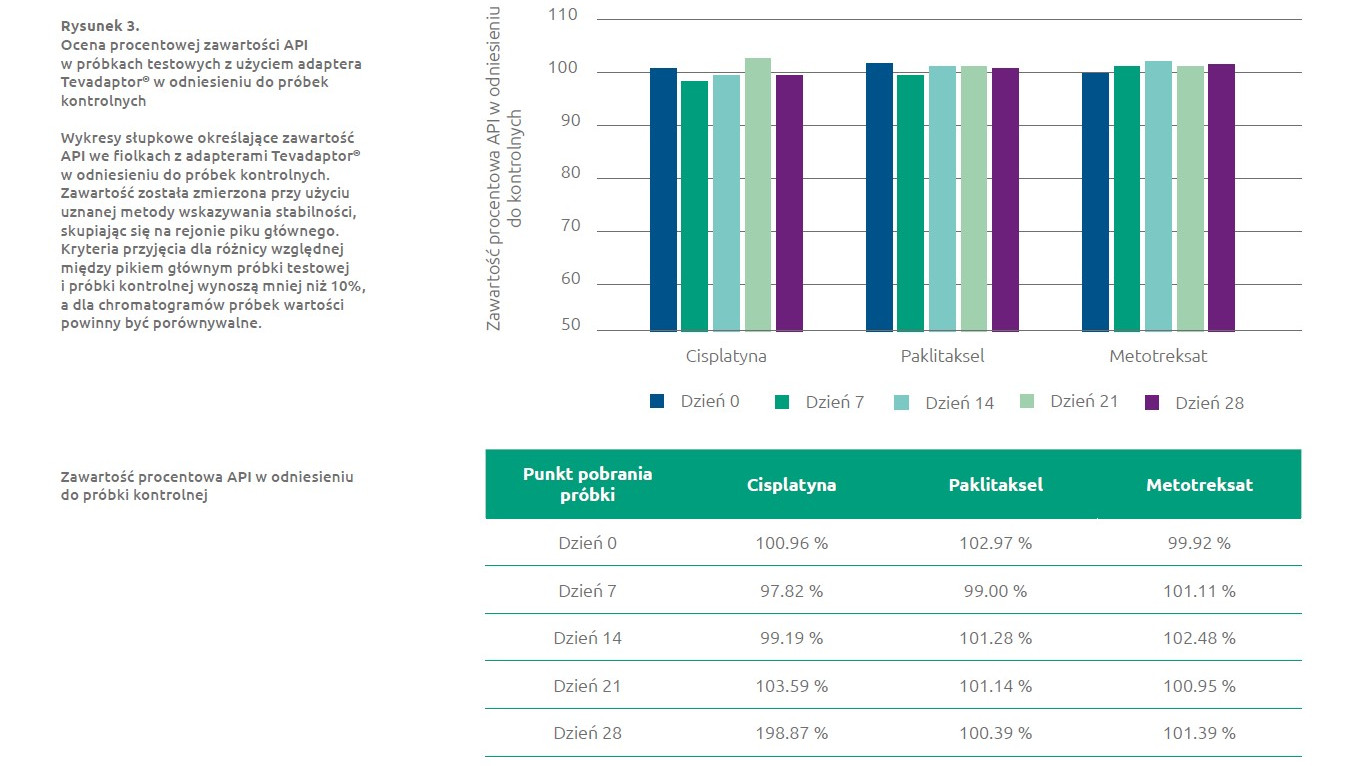
Analiza HPLC
Aby dokonać oceny integralności chemicznej aktywnego składnika leku (aktywny składnik farmaceutyczny — API), zastosowano metodę wysoko sprawnej chromatografii cieczowej (HPLC) z detekcją diodową (DAD). Dla każdego leku opracowano metody HPLC dla wskazania stabilności w oparciu o opublikowane już metody(9, 10, 11). Przed zastosowaniem w badaniu zweryfikowano każdą z nich. Przed badaniem i na każdym z punktów czasowych badania dla każdego leku, w odpowiednim zakresie stężenia, przeprowadzono standardowe kalibracje pod kątem reakcji i liniowości przyrządów. Kryteria przyjęcia w ramach badania dla profilu chromatograficznego próbki testowej były jakościowo zbliżone do kryteriów próbki kontrolnej, a dla rejonu piku głównego próbki testowej przyjęto tolerancję 10% wartości uzyskanej w przypadku próbki kontrolnej. Podobieństwo chromatogramów ustalono na podstawie analizy czystości piku i analizy wyniku dopasowania, co było możliwe dzięki oprogramowaniu Chromeleon (v6.4) działającego w systemie operacyjnym Windows 2000. Podsumowanie wyników badań przedstawia Rysunek 3. Profile chromatogramów próbek testowych i kontrolnych były porównywalne we wszystkich punktach czasowych. Różnica procentowa między pikiem głównym próbek testowych i próbek kontrolnych wynosiła mniej niż 10% dla wszystkich badanych próbek, dowodząc stabilności chemicznej produktu leczniczego w całym 28-dniowym okresie badań.
Klarowność, barwa roztworu i brak obecności cząsteczek stałych
Przeprowadzono kontrolę wzrokową dwóch próbek testowych i dwóch próbek kontrolnych w celu dokonania oceny roztworu pod względem jego klarowności, barwy i obecności w nim cząsteczek stałych. Kontrolę wzrokową przeprowadzono na białym i czarnym tle (matowym), używając w tym celu żarówki fluorescencyjnej barwy białej zgodnie z wymaganiami Farmakopei Brytyjskiej(12). W ramach kryteriów przyjęcia zastosowanych do oceny stabilności ustalono wymóg, że roztwór powinien pozostawać klarowny i nie powinny w nim występować jakiekolwiek cząsteczki stałe. Roztwór cisplatyny i paklitakselu pozostawał bezbarwny, a roztwór metotreksatu utrzymał tę samą barwę, co na początku badania i zgodnie z danymi wykazanymi w podsumowaniu charakterystyki produktu udostępnionej przez producenta. W przypadku wszystkich trzech leków badanych w okresie 28 dni nie stwierdzono żadnych zmian pod względem barwy czy klarowności roztworu. Stwierdzono, że pod koniec badania (dzień 28) w żadnej z próbek testowych nie występowały widoczne cząsteczki stałe.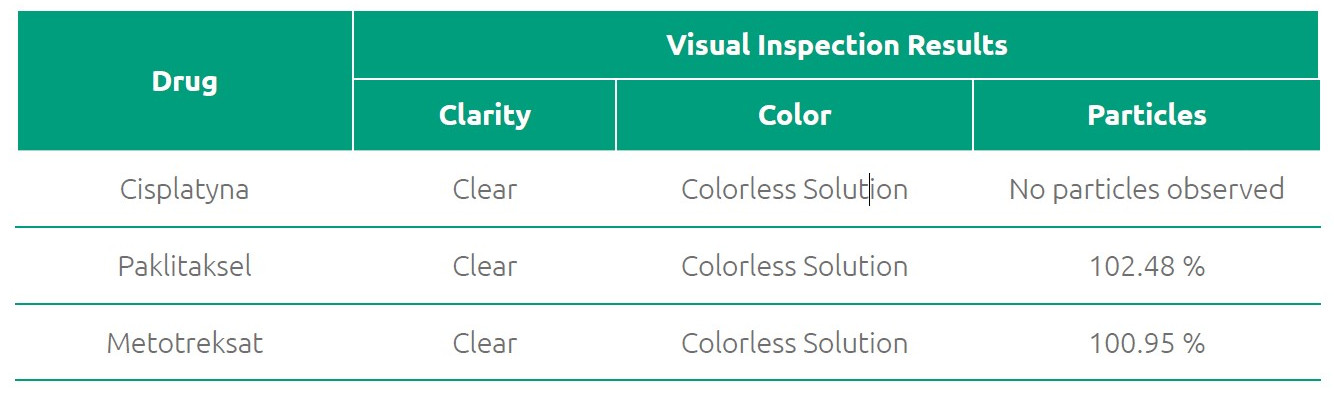
Wnioski z badań
W powyższym badaniu badaliśmy stabilność fizykochemiczną podczas stosowania jednorazowych i gotowych do użycia fiolek cisplatyny (1 mg/ml, pojemność 100 ml), paklitakselu (6 mg/ ml, pojemność 50 ml) i metotreksatu (25 mg/ml, pojemność 40 ml). Stabilność podczas stosowania została poddana trwającej 28 dni kontroli przy cotygodniowym pobieraniu podwielokrotnych części leków. Stabilność leków we fiolkach, z których pobierano próbki przy użyciu standardowej sterylnej strzykawki i igły, porównano z fiolkami zestawionymi z adapterem fiolki Tevadaptor®, przy czym próbki były pobierane z zastosowaniem adaptera strzykawki Tevadaptor® i sterylnej strzykawki. We wszystkich próbach fizykochemicznych przeprowadzonych dla ciplatyny i paklitakselu próbki pobrane przy zastosowaniu systemu Tevadaptor® wykazywały parametry analogiczne, co próbki kontrolne pobrane przy użyciu standardowej strzykawki i igły. Nie wykazano żadnych dowodów świadczących o degradacji leku lub utracie integralności w okresie 28 dni po pierwszym nakłuciu fiolki leku. W przypadku metotreksatu nie zauważono żadnych zmian w profilu HPLC lub w wyglądzie próbek z fiolek zestawionych z adapterem Tevadaptor® w odniesieniu do próbek kontrolnych. Zaobserwowano nieznaczną odchyłkę spadkową w wartościach pH w obu zestawieniach próbek przy nieznacznej odchyłce wzrostowej w próbkach z fiolek zestawionych z adapterem Wszystkie próbki (kontrolne i z fiolek zestawionych z adapterem Tevadaptor®) utrzymały wartości w zakresie 7,0–9,0 pH specyfikacji określonej w monografiach poświęconych metotreksatowi do wstrzyknięć, ujętych w Farmakopei Stanów Zjednoczonych i Farmakopei Brytyjskiej. Badanie sterylności wielu fiolek leku (n=332) przyniosło potwierdzenie, że w przypadku wszystkich trzech produktów w całym 28-dniowym okresie prowadzenia badań i następującym po nim 14-dniowym okresie inkubacji została utrzymana sterylność. Sterylna bariera pozostała nienaruszona w przypadku fiolek leków zestawionych z systemem Tevadaptor®, nawet po wielokrotnych pobraniach z fiolek testowych w 28-dniowym okresie prowadzenia badań. Przy rosnącej presji wywieranej na szpitale, aby zmniejszać koszty ponoszone na zakup leków, farmaceuta szpitalny staje przed wyzwaniem określenia działań mających na celu obniżenie marnotrawstwa leków bez wywierania wpływu na bezpieczeństwo i skuteczność stosowania leków. Dane zaprezentowane w niniejszym badaniu mogą zostać wykorzystane przez farmaceutę w celu ułatwienia sobie wyboru przy podejmowaniu decyzji o wydłużeniu praktycznego okresu trwałości leków podczas ich stosowania, korzystając z systemu Tevadaptor®.
lub wyślij email na bmtmedical@biameditek.pl
Odniesienia- Peelen i in. „Toxic Effects on Reproduction in Hospital Personnel” Haga, Holandia: Holenderskie Ministerstwo Spraw Społecznych i Zatrudnienia, (1999), ISBN 9-5749-255-5.
- Wick i in. „Using a closed-system protective device to reduce personnel exposure to antineoplastic agents”. Am J Health Syst. Pharm., (2003) 60: ss. 2314–2320
- Międzynarodowe Towarzystwo Praktyków Farmacji Onkologicznej (ISOPP). Standardy praktyczne lSOPP. Bezpieczne obchodzenie się ze środkami cytotoksycznymi. Journal of Oncology Pharmacy Practice, 2007,13 (Dodatek): ss. 1–81
- E. Thomas Carey i in. „Second look at utilization or a Closed-System Transfer Device (PhaSeal)”. American Journal of Pharmacy Benefits, (2011) (6), ss. 311–31
- Edwards M.S. i in. „Cost Savings Realized by use or a closed-system transfer device (CSTD) for Preparation of Antineoplastic Agents”; (2013). Haematology Oncology Pharmacy Services, Walter Reed National Military Medical Centre, Washington DC., ASHP midterm 2013 conference poster presentation, Orange Country Conference Centre, Orlando Florida, US.
- Vandenbroucke i in. „Economic impact of the preparation scenario for cytotoxic drugs: an observational study”, European Journal of Hospital Pharmacy, (Practice), (2008), 14, ss. 37–42
- McMichael i in. „Utility of the PhaSeal closed system drug transfer device”, American Journal of Pharmacy Benefits. (2011); 3(1): ss. 9–16
- Farmakopea Stanów Zjednoczonych — Narodowy Receptariusz, Rozdział ogólny <797> Przewodnik składania farmaceutycznego — Przygotowywanie produktów sterylnych. Rockville, MD: United States Pharmacopeial Convention; 2008. http://www.usp.org/products/797/Guidbook/. Dostęp: 1 października 2013 r.
- Sewell i in. „Physical and chemical stability of cisplatin infusions in PVC containers”. European Journal of Oncology Pharmacy (2010) 4(3):11–14
- Donyai P. Sewell GJ. „Physical and chemical stability of paclitaxel infusions in different container types”. J Oncol Pharm Pract. (2006) Dec. 12(4):211–22.
- Arnaud i in. „Stability and compatibility of 2.5 mg/ ml methotrexate solution in plastic syringes over 7 days”. International Journal of Pharmaceutics (1996) 128:283–286. 12. Farmakopea Brytyjska, Załącznik XIII B. Zanieczyszczenie cząsteczkowe: Widoczne cząsteczki (Ph. Eur. method 2.9.20)
- Wstrzykiwanie metotreksatu. Farmakopea Brytyjska 2014, wersja 18.
- Metotreksat do wstrzykiwania. Farmakopea Stanów Zjednoczonych 36 i Narodowy Receptariusz 38
- Dane w aktach
W tej samej kategorii
- Monitorowanie i analiza epizodów bezdechu, bradykardii i desaturacji (ABD) w monitorach pacjenta BeneVision serii N oraz ePM
- Czy koronawirus może powodować arytmię serca?
- Badanie jakości jednorazowego bronchoskopu Ambu aScope 4
- Prawidłowe pobieranie BAL –popłuczyn oskrzelowo-pęcherzykowych w trakcie bronchoskopii
- Ekonomia Wentylacji Jednego Płuca